Effects of hydrothermal pretreatment on the sulfadiazine degradation in anaerobic digestion system of pig manure
-
摘要:
为进一步了解水热预处理对猪粪连续厌氧消化过程中磺胺嘧啶(sulfadiazine, SDZ)降解机制的影响,以及对厌氧消化系统性能的影响效果。该研究以猪粪为对象,对比研究了水热预处理对厌氧发酵模式下SDZ的降解变化规律与途径及其对猪粪产气性能的影响。研究结果表明:水热预处理(150 ℃)使中温连续厌氧反应器中的SDZ的综合去除率显著提升(P <0.05),由40.5%~58.5%提高到54.4%~75.2%;并且通过中间降解产物推测SDZ的生物降解途径主要包括SDZ水解、羟基化、硫脱氧、氨基氧化、嘧啶环裂解等;在厌氧消化性能方面,水热预处理使稳定运行后反应器的日产沼气量提高了约34.05%(P <0.05)。此外,对反应器中微生物群落分析后,发现Syntrophomonas、Sedimentibacter与SDZ的降解高度相关,并且经过水热预处理后Sedimentibacter的相对丰度较未水热预处理显著提升。因此,水热预处理耦合厌氧消化工艺具有同步提高SDZ降解和厌氧消化性能的作用,有助于进一步提高沼液的生态安全性。
Abstract:Hydrothermal pretreatment (HTP) can be used to decompose the sulfadiazine (SDZ) during continuous anaerobic digestion (AD) of pig manure. This study aims to explore the effect of HTP on the SDZ degradation and performance of AD system. Pig manure with SDZ was taken as the research object. A comparison was made on the degradation regular, SDZ paths and products, as well as the gas production performance of pig manure with/without HTP during AD. The results showed that the HTP (150 °C) significantly increased the comprehensive removal rate of SDZ in the mesophilic continuous AD reactor (P <0.05), particularly from 40.5%~58.5% to 54.4%~75.2%. Moreover, the biodegradation paths of SDZ were inferred through intermediate degradation products, including SDZ hydrolysis, hydroxylation, thiodeoxidation, amino oxidation, nitroation, amidation and pyrimidine ring cleavage. HTP enhanced the degradation products and paths of SDZ, biodegrade SDZ from different degradation paths, and the removal rate of SDZ. There were four paths of degradation in pig manure with HTP, while there was only one degradation path without HTP. In terms of AD performance, the system was stabilized after 25 days, the daily gas production in the R0 reactor was stable at 5.14 L/d, and the cumulative VS gas production rate was 16.64 L/g; In the R0h reactor, the daily gas production was stable at 6.89 L/d, and the cumulative VS gas production rate was 22.31 L/g. The daily biogas yield of the reactor and the volume production rate increased by about 34.05% (P<0.05), and 34.00%, respectively, after stable operation with HTP. There was little difference in the methane content between the two reactors after two SRTs. The average contents of methane in R0 and R0h reactors were 61% and 59%, respectively. Thus, the AD process was stable in the two groups of reactors over the whole operation stage, according to the biogas production rate and methane content. The degradation of organic matter was also enhanced for the high concentration of VFAs after HTP. The substrate was provided for the subsequent stage of methane production, in which the acetic acid content accounted for 25.3%~46.1%. In addition, the microbial communities showed that Firmicutes and Bacteroidota were the dominant phylum bacteria in the reactors during anaerobic fermentation. Their relative abundance was beneficial to the degradation of antibiotics. A comparative analysis was also made on the microbial community at the class level. It was found that Clostridia and Bacteroidia were the main microorganisms in the two reactors. The relative abundance of Proteiniphilum increased after HTP. The full hydrolysis of pig manure was also realized for the better performance of methane production. Meanwhile, it was found that Syntrophomonas and Sedimentibacter were highly correlated with the degradation of SDZ, and the relative abundance of Sedimentibacter after HTP was significantly higher than that without HTP, indicating the better degradation of antibiotics. Therefore, the HTP coupled with the AD process can be expected to simultaneously improve the degradation of SDZ and AD performance, particularly for the ecological safety of biogas liquor.
-
Keywords:
- manure /
- digestion /
- hydrothermal pretreatment /
- sulfadiazine /
- anaerobic digestion
-
0. 引 言
抗生素的使用可以促进动物的生长以及预防和治疗疾病,因此在畜牧业的集约化生产中得到了广泛应用[1]。磺胺嘧啶(sulfadiazine, SDZ)作为一种典型的磺胺类抗生素,因其广谱性和高抗菌性,常被用作饲料添加剂[2]。但动物对抗生素的吸收有限,其30%~90%会以抗生素原形态通过尿液和粪便排出[3],导致粪便中存在高浓度的抗生素,WOHDE等[4]报道粪便中的SDZ浓度高达5.0~235.1 mg/kg。这些抗生素进入环境之后会改变微生物的组成和功能,并且长期暴露在抗生素中耐药细菌会产生抗性基因,进一步会促进“超级细菌”的产生,对人类健康和生态系统造成影响。并且SDZ具有强大的持久性和抗菌作用,很难从自然环境中完全去除[5]。因此,畜禽养殖粪污中抗生素的消除越来越受到关注。
由于高有机负荷和低运营成本,厌氧消化(anaerobic digestion, AD)已被广泛用于畜禽粪污的处理和利用,已有研究报道在厌氧消化过程中能够降解抗生素,其降解效率依赖于抗生素的种类、浓度、发酵条件等[6]。例如,靳红梅等[7]通过中温厌氧发酵批式试验发现,猪粪中SDZ的降解效率为58.7%。在厌氧反硝化系统中,70 h后起始浓度为50 mg/L的SDZ降解效率达98.52%[8]。在鸡粪中温厌氧消化作用中,高浓度的金霉素(质量浓度≥60 mg/L)去除率为 43.4%~51.44%;由此可知,通过厌氧消化并不能完全将抗生素消除。
水热预处理(hydrothermal pretreatment, HTP)作为一种新型的生物质预处理技术,能够通过提高温度降低抗生素的水解半衰期,对部分抗生素能达到很好的去除效果。例如,猪粪经过70 ℃的水热预处理60 min后,金霉素的去除率为71%[9]。AWAD等[10]发现抗生素发酵残留物经过110 ℃加热5 min后,土霉素的去除率为99.2%。此外还能够增加水解液中易降解有机物的含量,一定程度的提高厌氧消化性能。LI等[11]对抗生素菌丝体残留物研究发现,在120℃水热预处理60 min后沼气和甲烷产率达到峰值,分别约为446 和290 mL/g,该甲烷产量比直接消化原始抗生素菌丝体残留物的甲烷产量高约3倍。KIM等[12]对牛粪厌氧消化性能研究发现,经过160 ℃水热预处理30 min后,当水力停留时间为21.8 d时,水热牛粪的甲烷产量比未经处理的提高了1.4倍,且挥发性固体去除率提高了1.9倍。水热预处理已经应用于处理污泥、发酵残渣[10, 13],而目前在畜禽粪污抗生素的降解上还少有应用。并且许多文献分别研究了厌氧消化和水热预处理对抗生素降解的变化规律,却很少有文献将上述两种技术集成并研究其整体处理效果。基于水热预处理和厌氧消化都能够在一定程度上降解抗生素,水热预处理与厌氧消化耦合对畜禽粪污中的典型抗生素SDZ降解的联合作用效果、降解途径及对产甲烷性能的影响效果尚不清楚。
目前,关于SDZ的微生物降解途径已有部分报道,主要集中研究了SDZ的降解产物和降解路径。例如,WANG等[14]通过液相色谱-质谱分析表明SDZ可通过生物降解为 2-AP, 2 A4HP和苯亚磺酸。DENG等[15]报道Arthrobacter sp.菌属D2和D4能够利用SDZ作为唯一碳源,2-AP是生物降解的主要产物。在厌氧反硝化体系中,能够降解SDZ的化学反应主要包括磺胺键水解、羟基化、硫脱氧、脱氨基、氨基氧化和硫脱氧[8]。然而,据我们所知,SDZ在水热预处理耦合厌氧消化体系中的降解机理,以及SDZ降解与反应器微生物之间的相关性的研究尚不充分。
因此,本研究以含SDZ的猪粪为原料,对比分析150 ℃水热预处理对猪粪中温连续厌氧过程中SDZ降解规律与产物,厌氧消化性能及其细菌微生物菌群分布的影响,评估水热预处理耦合厌氧消化对SDZ降解的强化作用,阐明水热预处理对厌氧消化系统中SDZ降解代谢的影响机制,以期为畜禽粪污资源化利用过程中抗生素的强化降解与沼液风险因子消减提供了一种可行性方法。
1. 材料与方法
1.1 猪粪原料
本试验采用的猪粪取自国家昌平综合农业工程技术中心畜禽分中心(养殖期间未使用抗生素),清粪方式为干清粪,新鲜猪粪取回时总固体(total solid, TS)质量分数约为35%,放置于4 ℃冷库中。将SDZ添加到原猪粪中,并用蒸馏水稀释得到含有150 mg/L抗生素的猪粪原料,猪粪原料的TS为21.58%,挥发性固体(volatile solid, VS)为16.98%,碳氮比(C/N)为12.27,氨氮(NH4+-N)浓度为2 485.47 mg/L,使用搅拌机搅拌使其均质,当天进行水热预处理试验。在后续厌氧消化试验阶段,为了方便进出料,将水热预处理和未水热预处理的猪粪原料TS稀释为10%作为厌氧消化反应器的进料。厌氧发酵反应器中的接种污泥为取自北京排水集团的市政污泥,厌氧消化试验启动前将接种污泥放置于37 ℃下驯化一周后使用。接种污泥的TS为6.33%,VS为3.2%,C/N为6.69,NH4+-N浓度为1 292.31 mg/L。
1.2 试验装置
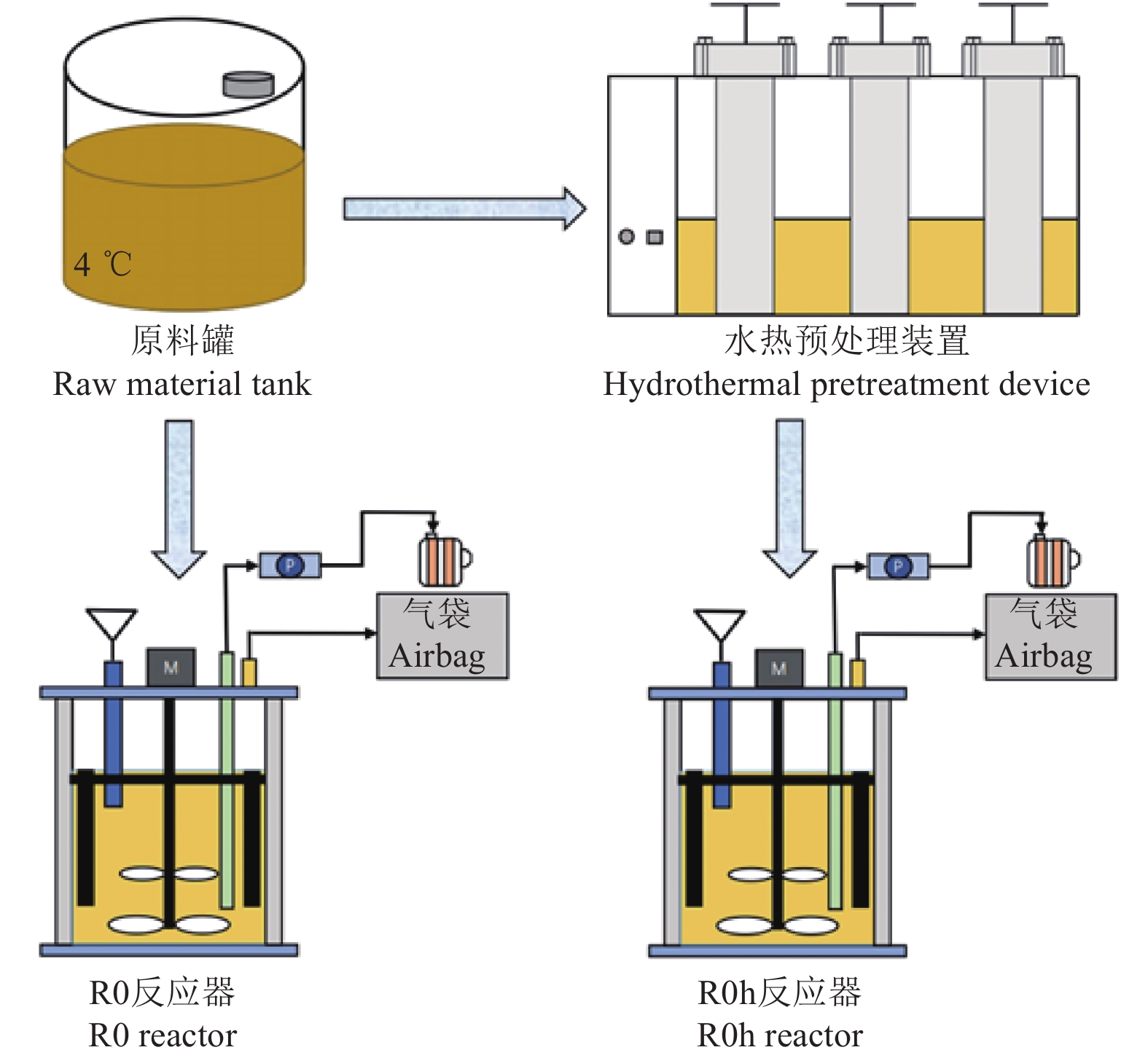
本研究所用的试验装置包含进行猪粪预处理的水热预处理装置和连续厌氧消化试验的连续搅拌釜式反应器, 厌氧消化反应器配有由电机驱动的不锈钢轴和桨叶,试验装置示意图如图1所示。
1.3 试验处理
1.3.1 水热预处理
猪粪的水热预处理试验在有效容积为1 L的反应釜中进行,每个反应釜中加入0.5 L调制好的含SDZ猪粪,通过导热油作为介质对反应釜进行加热,基于先前研究不同水热预处理温度的厌氧消化性能,发现150 ℃,30 min获得最大产甲烷量[16],因此设定温度为150 ℃,加热30 min,待温度升高至150 ℃时开始计时。待水热反应结束时,将反应釜放入冷水中强制降温冷却,冷却后取一部分样品保存于-20 ℃(1周)的冷库中用于抗生素的检测分析,剩余的样品保存在4℃用于第2天厌氧消化试验的原料。
1.3.2 厌氧消化
厌氧发酵在两个连续搅拌釜式反应器(CSRTs,R0和R0 h)中进行,其中R0反应器中以未经水热预处理的含SDZ猪粪进料作为对照组,R0 h反应器以150 ℃水热预处理含SDZ猪粪进料作为试验组。两组试验使用的反应器有效容积为5 L,连续运行时间为80 d,固体停留时间(solid retention time, SRT)为25 d。反应器均在(37±1)℃恒温水浴中运行,每天以 180 r/min的速度对反应器进行连续搅拌。初始两个反应器中分别加入5 L新鲜接种污泥,随后每天进行一次手动进料,进料量为200 mL, TS为20 g。反应器外部连接蠕动泵和气袋,以备出料和收集气体。反应器运行过程中,每天测定沼气日产气量、CH4、CO2体积分数、pH值;每2 d 测定TS、VS;每4 d测定NH4+-N、SDZ、挥发性脂肪酸(volatile fatty acids, VFAs)的浓度变化,每个样品检测重复3次;取第80天水热和未水热预处理猪粪的厌氧消化液进行SDZ降解产物的检测。
1.4 测定指标及分析方法
1.4.1 常规指标检测
TS、VS采用重量法测定;pH值采用玻璃电极法测定;氨氮的测定采用纳氏试剂分光度法,步骤参考行业标准HJ 535-2009进行;采用玻璃注射器测定沼气量,通过色谱仪(日本岛津GC-8A)检测沼气的气体组成(CH4和CO2)。VFAs采用GC-2010 Plus(日本岛津)测定,具体操作方法如文献[16]所述。
1.4.2 SDZ与降解产物检测
取10 mL样品以4 000 r/min, 4 ℃离心15 min,液体样品先经0.45 µm水系滤膜过滤,加入磷酸调节pH值至2~3之间,再经0.22 µm滤膜过滤待测;离心后固体样品,先用冻干机在-80 ℃冻干10 h,精确称取0.5 g冻干猪粪到10 mL离心管中加入3 mL乙腈+ Na2EDTA-磷酸盐缓冲溶液(pH值为3;体积比=1∶1),涡旋1 min,超声20 min,在8 000 r/min、4℃的条件下离心20 min取上清液备用。用5 mL甲醇和5 mL超纯水活化HLB固体萃取柱,然后以5 mL/min流速进行上样,用10 mL超纯水淋洗,用真空抽干柱子,再用8 mL甲醇洗脱并吹至近干,用10%甲醇溶液稀释至1 mL,涡旋均匀后过0.22 µm有机滤膜,上机待测。采用高效液相色谱-紫外检测法(HPLC-UV)在270 nm处进行紫外检测,测定样品液体和固体中SDZ的浓度,具体检测方法参照文献[6]。另外,以色谱级0.1%甲酸(A)为水相,乙腈(B)为有机相,采用液相色谱串联高分辨质谱(UPLC-MS-MS)对SDZ代谢产物进行检测, 样品预处理方式如上所述。液相条件:ACQUITY UPLC HSS T3色谱柱(2.1 mm×100 mm, 1.8 µm),柱温为35℃,进样体积为10 µL,流动相的洗脱梯度为:0~10 min:A:B=100:0(A与B的体积比,下同);10~20 min:A:B=70:30; 20~25 min:A:B=50:50; 25~25.1 min:A:B=0:100; 25.1~30 min:A:B=100:0。样品质谱检测采用Q Exactive Orbitrap高分辨质谱进行质谱数据采集,检测模式为Full MS-ddMS2,在正离子和负离子模式下分别扫描,质量扫描范围为100~1200 m/z,质谱仪的参数设置根据文献[17]设定。
1.4.3 微生物群落分析
为研究不同反应器、不同阶段微生物群落的变化,对16S rRNA进行了测序分析。测序样品包含接种污泥SL、原猪粪PM、R01(原猪粪消化1 d)、R015(原猪粪消化15 d)、R060(原猪粪消化60 d)、150 ℃水热猪粪HPM、R0 h1 (水热预处理猪粪消化1 d)、R0 h15 (水热预处理猪粪消化15 d)、R0 h60 (水热预处理猪粪消化60 d)。样品的DNA提取、PCR扩增、Illumina测序均基于先前报道的方法进行[18]。 Illumina测序得到的PE reads进行样本拆分后,首先根据测序质量对双端Reads进行质控和过滤,同时根据双端Reads之间的overlap关系进行拼接,获得质控拼接之后的优化数据。然后使用序列降噪方法(DADA2)处理优化数据,获得ASV(amplicon sequence variant)代表序列和丰度信息。基于ASV代表序列及丰度信息,进行物种群落丰富度、多样性分析,以及物种群落和环境因子相关性分析等一系列的统计学和可视化分析。
1.4.4 数据分析方法
实验数据采用Microsoft Office Excel 2021进行统计计算和绘图、利用SPSS 26.0软件进行差异性分析。此外,微生物数据分析在美吉生物云平台(https://cloud.majorbio.com)上进行,具体如下:采用mothur[19]软件(http://www.mothur.org/wiki/Calculators)计算Alpha多样性指标,如Chao、Shannon指数等;基于spearman相关性系数评估微生物与环境变量之间的相关性进行相关性分析。
2. 结果与分析
2.1 水热预处理对厌氧消化过程中SDZ降解的影响
2.1.1 SDZ的降解规律
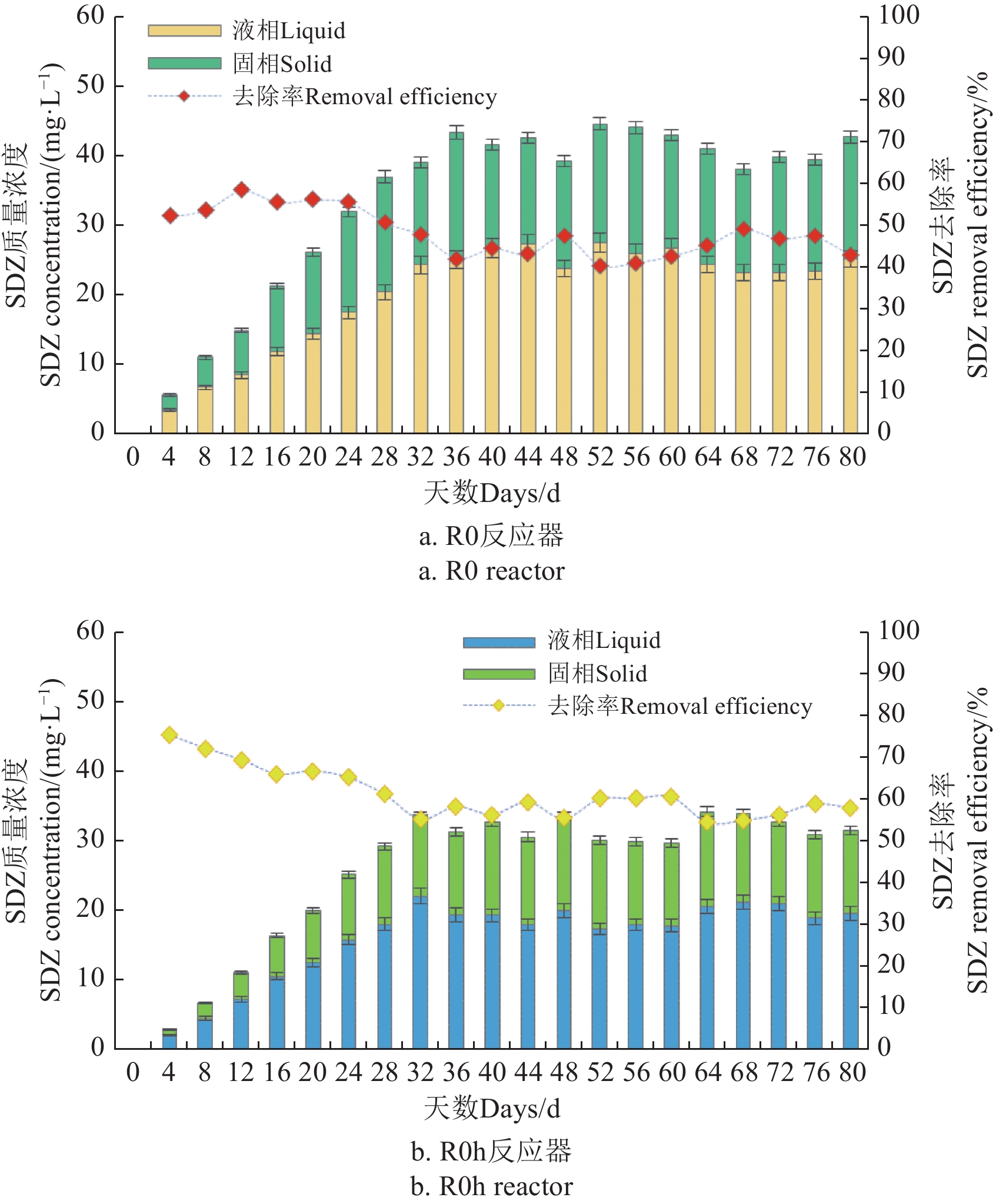
连续厌氧消化系统中,每天猪粪进料中SDZ的质量浓度为75.0 mg/L,从启动阶段到稳定阶段,SDZ的降解情况如图2所示。在反应器的启动期,SDZ的浓度缓慢增长,经过一个SRT后最终达到稳定状态。固液两相中的SDZ浓度随时间动态变化,其中R0反应器在稳定状态时,液相中的SDZ质量浓度范围为20.5~27.6 mg/L,固相中SDZ质量分数范围为14.7~18.2 mg/ kg;相应的在R0 h反应器中,液相的SDZ质量浓度范围为17.4~22.0 mg/L,固相中SDZ质量分数范围为11.2~13.7 mg/ kg。固相中存在的SDZ可能是由于污泥对SDZ起到了一定的吸附作用。
经过水热预处理猪粪中的SDZ含量有所下降,固液两相浓度和为45.0 mg/L,水热预处理可以极大地改变生物质的表面结构和特性,可能有助于抗生素的解吸和溶解浓度的增加,然而经过水热预处理后,SDZ浓度降低,这可能是抗生素在高温下的部分水解[20-21]。在厌氧系统中,固相和液相的SDZ均有所下降。对比水热预处理和未水热预处理猪粪,R0 h反应器的综合去除率(固液两相中的去除率)显著提升(P <0.05),其中R0反应器去除率为40.5%~58.5%,R0 h反应器的去除率为54.4%~75.2%,表明水热预处理可以提高厌氧消化过程中抗生素的去除率,AWAD等[10]也得出了同样的结论。在反应器运行的第一个SRT期间,抗生素的去除率呈下降趋势,尤其在R0 h反应器中SDZ去除率由75%降到61%。在先前的研究中,报道去除抗生素的主要机制是物理吸附[22],基于这一推断,厌氧系统中对抗生素的吸附作用可能在第一个SRT期间达到饱和,随后进行缓慢的生物降解。经过一个SRT后,两组反应器中SDZ的去除率没有明显的变化,可能归因于厌氧系统中的微生物对抗生素产生了耐药性[23]。当SDZ的含量升高,其去除率与较低起始SDZ含量的去除率相比有所下降,例如当SDZ初始浓度为2.39 mg/L时,经过150 ℃水热预处理后,SDZ残留仅为20%[24],可能是由于SDZ达到了生物降解的最大值,SDZ无法被进一步降解。
2.1.2 SDZ的生物降解路径与产物
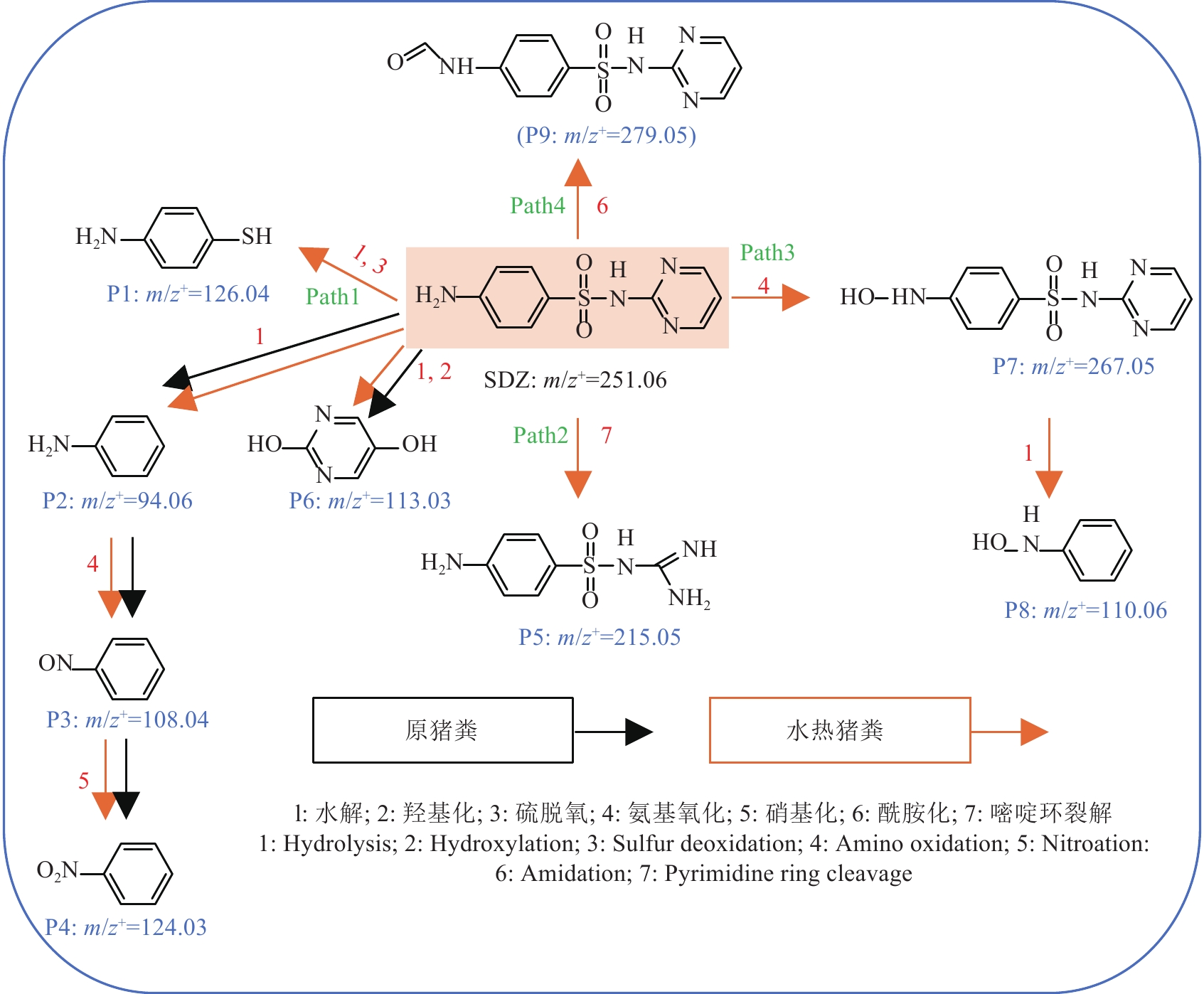
为了了解水热和未水热预处理猪粪中SDZ在厌氧消化系统中的降解途径,采用UPLC-MS-MS检测SDZ的中间产物。在本研究中,根据检测的质量/电荷比和分子结构推测了SDZ和9个副产物(分别为P1: 4-氨基硫酚,P2:苯胺,P3:亚硝基苯,P4:硝基苯,P5:4-氨基-N-脒基苯磺酰胺,P6:2,5-二羟基嘧啶,P7:4-羟基氨基-N-(嘧啶-2-基)苯磺酰胺,P8:未知(分子式为(C6H7NO),P9:N-甲酰基磺胺嘧啶),提出了SDZ的生物降解机理,包括7种不同的反应:1. 水解;2. 羟基化;3. 硫脱氧;4. 氨基氧化;5. 硝基化;6. 酰胺化;7. 嘧啶环裂解[14]。 最后,根据检测到的主要中间产物,确定了SDZ在水热和未水热预处理猪粪厌氧消化体系中的降解途径(图3)。
如图3所示,在原猪粪厌氧消化体系中,检测到1条降解途径。SDZ的磺胺键被水解,研究发现首先生成对氨基苯磺酸和2-氨基嘧啶[25]。但是本研究中未发现这两种降解产物,很大可能在后续厌氧消化过程中被降解或完全转化为后续物质。对氨基苯磺酸可进一步水解生成苯胺(P2: m/z+=94.06),之后苯胺上的氨基氧化反应,生成亚硝基苯(P3: m/z+=108.04),之后再进一步硝基化生成硝基苯(P4: m/z+=124.03)。此外,由于苯环容易被羟基化,而嘧啶环的化学特征与苯环相似,因此,2-氨基嘧啶的羟基化在SDZ生物降解过程中起着至关重要的作用[26]。本研究中2-氨基嘧啶近一步羟基化生成2,5-二羟基嘧啶(P6: m/z+=113.03)(Path1)。
对于水热猪粪中的SDZ,在该体系中检测到4种降解途径(图3)。一方面,在SDZ生物降解过程中,SDZ的磺胺键被水解,形成苯胺(P2: m/z+=94.06),随后经过氨基氧化、硝基化过程,分别形成生成亚硝基苯(P3: m/z+=108.04)、硝基苯(P4: m/z+=124.03)。水解后的2-氨基嘧啶经过羟基化生成2,5-二羟基嘧啶(P6: m/z+=113.03),其水解过程与未水热猪粪相同。此外,在水热猪粪厌氧消化过程中,通过硫脱氧反应,对氨基苯磺酸失去2个氧原子被还原为4-氨基硫酚(P1: m/z+=126.04),这很可能与系统中硫代谢的功能微生物有关[27],未水热条件下未检测到这种物质。有报道表明,硫还原和羟基化都参与了SDZ的生物降解[28],在本研究中也出现了相同的降解机制(Path1)。另一方面,水热猪粪中SDZ通过打开嘧啶环和裂解C-N键生成4-氨基-N-脒基苯磺酰胺(P5: m/z+=215.05)[29] (Path2)。此外,水热猪粪中SDZ中氨基(-NH2)可能被氧化成羟胺基(-NH-OH)。因此SDZ可能被氧化形成4-羟基氨基-N-(嘧啶-2-基)苯磺酰胺(P7: m/z+=267.05)[3],之后水解断裂生成P8: m/z+=110.06的物质(Path3)。最后,水热猪粪中SDZ通过苯环氨基的酰胺化生成产物N-甲酰基磺胺嘧啶(P9:m/z+=279.05)[28] (Path4)。由此看出通过水热预处理可以增强SDZ的降解产物和途径,从不同降解路径对SDZ进行生物降解,提高SDZ的去除率。
2.2 水热预处理对SDZ猪粪厌氧消化性能的影响
2.2.1 pH值、VFAs、氨氮和VS变化
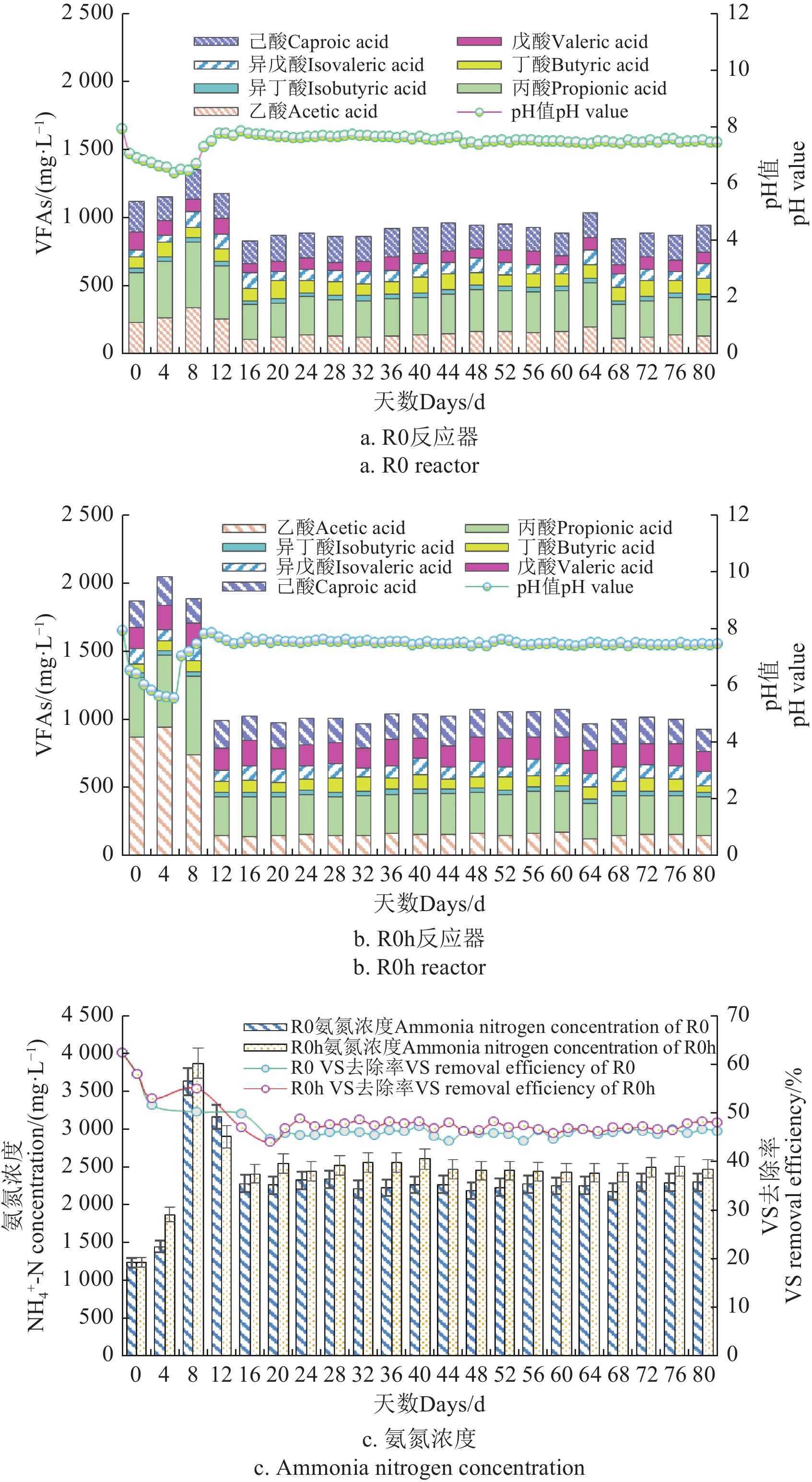
pH值在厌氧发酵体系中发挥重要作用,厌氧消化过程中的水解产酸、产甲烷阶段都会引起pH的变动。不同反应器中pH值变动如图4a和4b所示,由于试验一开始采用了较高的进料负荷,反应器在前期出现了pH值降低的酸化现象,VFAs大量的积累。通过向反应器中加入了适量的碳酸氢铵调节pH值后,系统第20天左右趋于稳定,R0和R0 h反应器中的pH值均保持在7.5附近,该pH值不会对产甲烷菌造成影响[30]。因此,水热猪粪中温厌氧消化系统中pH适宜,水热预处理并不会造成系统失稳。从VFAs浓度(图4a和b)也可以得到相近的结论,在启动期VFAs出现累积,其中R0 h反应器在第4天时TVFAs达到了最大值2.05 g/L,而R0反应器在第8天时TVFAs达到最大值1.15 g/L,明显低于经过水热预处理的反应器,其中乙酸含量占比25.3%~46.1%。随后VFAs开始下降,经过一个SRT以后,R0反应器中TVFAs能够稳定在0.9 g/L,R0 h反应器中稳定在1.0 g/L,这点与王明等[30]在猪粪中温半干法连续厌氧发酵实验中,当HRT为25 d,TS为10%时得出的TVFAs稳定在0.85 g/L相近。由此可知,经过水热预处理后系统能够增强有机物降解,提高VFAs的浓度,为后续产甲烷阶段提供底物。此外,有研究认为丙酸是造成系统酸化和产甲烷阶段效率低下的原因[31-32]。在本研究中,R0和R0 h丙酸在稳定阶段最高浓度为319 mg/L和322 mg/L,该值不足以破坏厌氧过程的稳定性。ZHAO等[33]发现,生成的丁酸浓度大于10 000 mg/L会提高厌氧过程中的氢气浓度,而本研究中R0和R0 h丁酸在稳定阶段最高浓度为137 和136 mg/L。
连续反应器中氨氮浓度的变化情况如图4c所示,在厌氧发酵启动期,由于氨基酸和蛋白质会被微生物分解转化为氨氮,氨氮的浓度逐渐上升,并且在第8天向系统中加入了碳酸氢铵,引起体系中氨氮的上升,R0和R0 h反应器中最高氨氮浓度达到3 632.6和3 873.1 mg/L。随后氨氮浓度下降,最终达到稳定状态2 200和2 450 mg/L。R0 h反应器中的氨氮浓度略高于R0反应器,这主要是因为溶解性蛋白质经过高温水热处理而逐渐分解生产氨氮等小分子产物[16],表明水热预处理能更好的将猪粪中的蛋白质和氨基酸降解。研究发现过量氨氮(>3.5 g/L)会对产甲烷菌产生抑制作用,导致其无法充分利用酸化产生的VFAs[34]。在本研究系统稳定时,氨氮浓度均低于该抑制浓度,氨氮对系统稳定性影响不大。
厌氧消化VS去除率可以反应厌氧消化过程中有机质的降解情况,由图4c可知,在稳定阶段,经过水热预处理的R0 h反应器在VS去除率(48%左右)略高于未经水热预处理猪粪R0反应器(46%左右),这与厌氧系统中产气量的变化趋势一致,也证实了水热预处理有助于提高猪粪原料的水解性能[16]。
2.2.2 产沼气情况
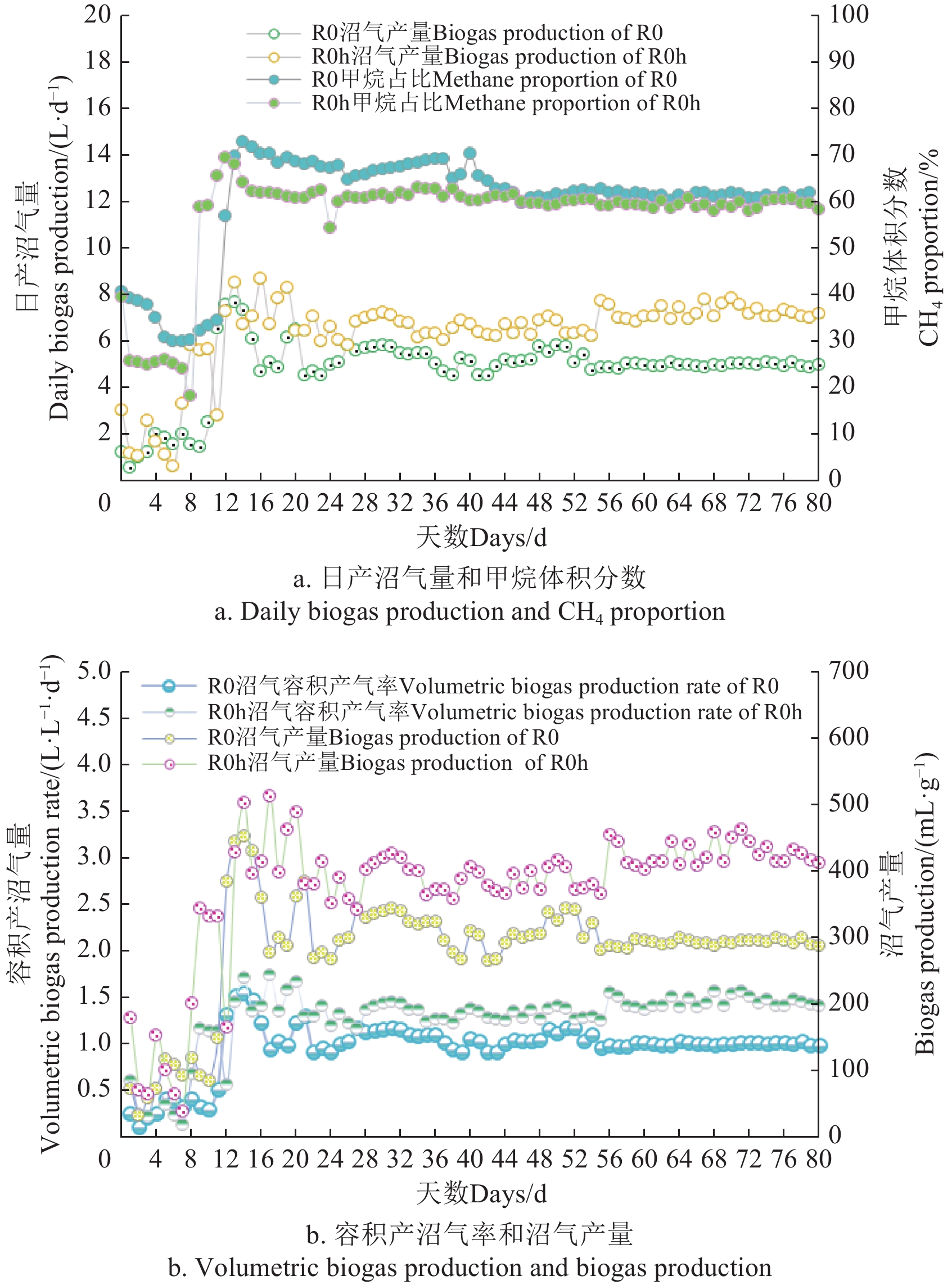
水热预处理猪粪和未水热预处理猪粪厌氧消化过程中的日产沼气量和甲烷含量如图5a所示。从图中可以看出,R0和R0 h反应器中产气量在第13天达到峰值,随后开始下降。经过1个SRT第25天后,系统开始稳定,在R0反应器中日产气量稳定在5.14 L/d,累积VS产气率为16.64 L/g; 在R0 h反应器中日产气量稳定在6.89 L/d,累积VS产气率为22.31 L/g,在水热预处理去除抗生素的同时提高了猪粪原料的产气性能,R0 h处理组的日产沼气产量提高了约34.05%。在R0反应器中,沼气中甲烷体积分数先稳定一段时间随后迅速增加,在发酵的第14天达到最大值72.88%。经过40 d后,甲烷体积分数下降并趋于稳定。在R0 h反应器中,沼气中甲烷体积分数变化趋势与R0反应器相似,先稳定一段时间随后迅速增加,在发酵的第12天达到最大值69.42%,随后甲烷体积分数下降并趋于稳定。系统经过2个SRT后,两组反应器中甲烷体积分数差异较小,R0和R0 h反应器中平均甲烷体积分数分别为61%和59%(图5a)。
容积产气率是表明厌氧发酵产气性能的重要指标,其大小是影响沼气工程生产成本的重要指标之一。容积产气率越大,则该系统产沼气量越大,达到沼气需求量所需要的发酵系统规模较小,工程实际运用中大大节约投资成本[35]。在R0与R0 h的反应器中,稳定状态时容积产气率分别1.03和1.38 L/(L·d)(图5b), 经过水热预处理容积产气率提高了34.00%, 其中未经水热预处理的反应器R0的容积产气率与实验室前期研究的沼气产率1.03 L/(L·d) 结果一致[36]。从整个运行阶段的沼气产气率和甲烷含量来看,两组反应器中厌氧消化运行过程稳定。
2.3 水热预处理对厌氧消化过程中细菌微生物的影响
厌氧消化系统中微生物群落的变化对整个消化系统的效率、抗生素的去除起着重要的作用。为了进一步研究不同反应器、不同阶段微生物群落的变化,对样品的16S rRNA进行了门、纲、属水平的测序分析。在高通量测序分析中,各样品中的微生物群落均表现出明显的差异性。
使用classfy-sklearn分类器,通过SILVA 16s-bacteria数据库对AVS代表序列进行分类学注释。为了更好的完成猪粪厌氧消化过程中微生物多样性和组成分析,按照最小样本序列数对每个样本序列抽平。Alpha多样性分析指数可以反应微生物群落的丰富度和多样性,其中Sobs和Chao指数反应群落的丰富度,且数值越大表明群落的丰富度越高;Shannon指数反应群落的多样性,且数值越大群落的多样性越高;Coverage指数反应群落的覆盖度,数值越大,表明该测序结果的越可靠。Alpha多样性结果如表1所示,Coverage 对9个样品的覆盖度超过 0.97,说明本次测序结果可以准确反映每个样品的微生物群落真实情况。R0与R0 h反应器中的Sobs和Shannon指数均高于原猪粪样品,表明厌氧消化系统提高了群落的丰富度和多样性。随着时间的推移,在两组反应器中物种的丰富度和多样性呈上升的趋势,但是第60天的物种丰富度和多样性都低于第15天,表明随着抗生素浓度的逐渐升高,部分微生物的生长可能受到抑制。R0 h反应器中的Sobs值高于R0反应器,表明水热预处理可以提高厌氧消化系统中微生物的丰富度。一般来说,细菌物种数和群落多样性越丰富,污染物的去除效果好[37]。
表 1 Alpha多样性指数表Table 1. Alpha diversity indices of the analyzed samples样本
SampelsSobs Chao Shannon Shannoneven Coverage SL 230 267.56 4.02 0.74 0.98 PM 111 117.38 2.88 0.61 0.99 R01 133 133.00 3.91 0.80 1.00 R015 247 273.54 4.51 0.82 0.99 R060 241 294.04 4.41 0.80 0.98 HPM 28 28.00 0.76 0.23 1.00 R0 h1 164 165.62 3.92 0.77 1.00 R0 h15 262 343.07 4.11 0.74 0.97 R0 h60 249 275.13 4.26 0.77 0.98 注:Sobs和Chao指数反映了微生物群落丰富度;Shannon指数反映了微生物群落多样性; Shannoneven指数反映了微生物群落的均匀度;Coverage指数反映了微生物群落的覆盖度。
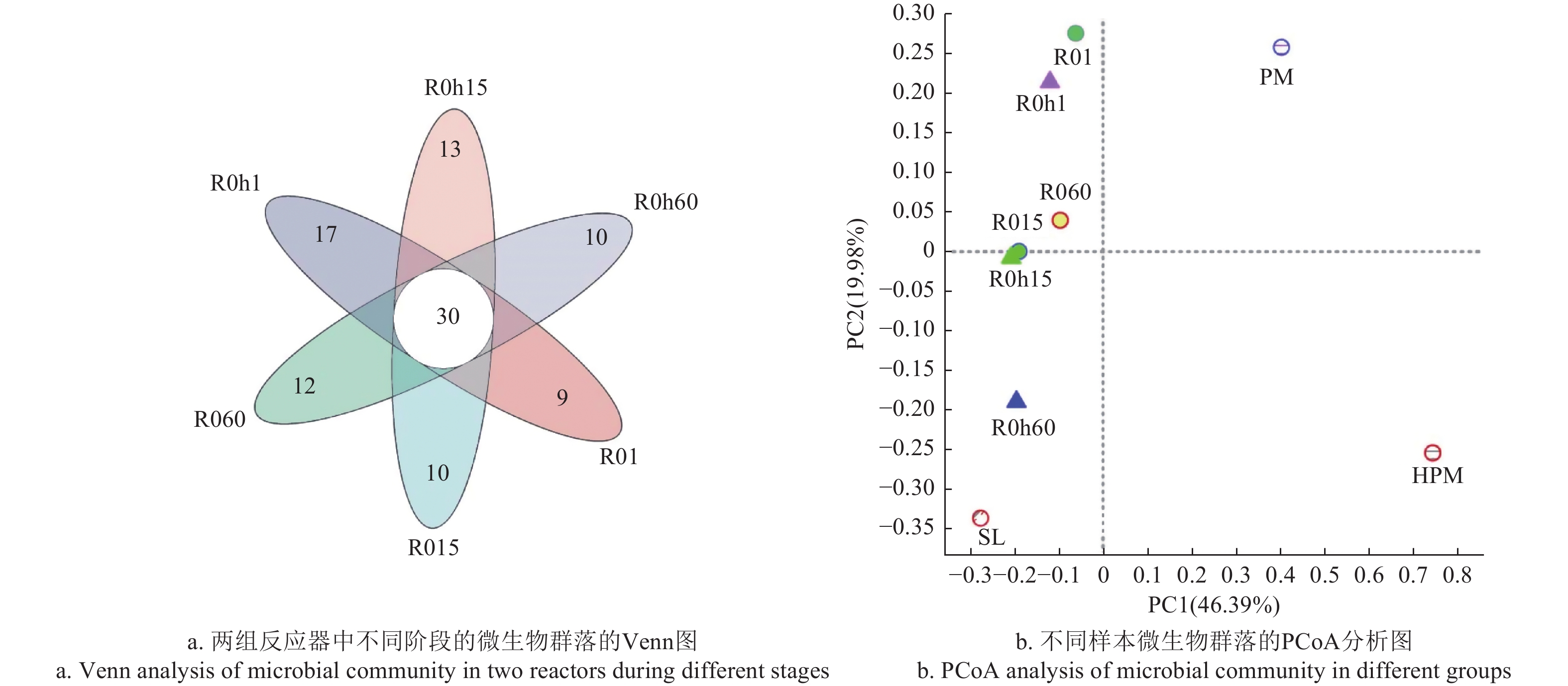
Note: Sobs and Chao indices reflect microbial community richness; Shannon index reflects microbial community diversity; Shannoneven index reflects microbial community evenness; Coverage index reflects microbial community coverage.Veen图主要来分析不同样本中共有物种和独有物种数,本研究利用Venn图比较两组厌氧消化系统中不同阶段属水平的物种差异和相似性。如图6a所示,6个样本中共有物种数为30个,在R0反应器中,随着反应器的运行,样本中的独有物种数逐渐增加,分别为9、10、12个;而在R0 h反应器中,样本的独有物种数在逐渐降低,分别为17、13、10个,相对于R0反应器波动较大。以上结果表明,经过厌氧消化和水热预处理,细菌群落会发生重大变化。
![]() 图 6 厌氧消化过程中微生物群落的Veen和PCoA图分析注:SL代表接种污泥;PM代表原猪粪;HPM代表水热猪粪;R01、R015、R060分别代表原猪粪厌氧消化第1、15、60天; R0 h1、R0 h15、R0 h60分别代表水热猪粪厌氧消化第1、15、60天。Figure 6. Veen and PCoA diagram of microbial communities during anaerobic digestionNote: SL represents the inoculate sludge; PM represents the raw pig manure; HPM represents the pig manure with HTP; R01, R015, and R060 represent days 1, 15, and 60 of anaerobic digestion of raw pig manure, respectively; R0 h1, R0 h15, and R0 h60 represent days 1, 15, and 60 of anaerobic digestion of pig manure with HTP, respectively.
图 6 厌氧消化过程中微生物群落的Veen和PCoA图分析注:SL代表接种污泥;PM代表原猪粪;HPM代表水热猪粪;R01、R015、R060分别代表原猪粪厌氧消化第1、15、60天; R0 h1、R0 h15、R0 h60分别代表水热猪粪厌氧消化第1、15、60天。Figure 6. Veen and PCoA diagram of microbial communities during anaerobic digestionNote: SL represents the inoculate sludge; PM represents the raw pig manure; HPM represents the pig manure with HTP; R01, R015, and R060 represent days 1, 15, and 60 of anaerobic digestion of raw pig manure, respectively; R0 h1, R0 h15, and R0 h60 represent days 1, 15, and 60 of anaerobic digestion of pig manure with HTP, respectively.为比较猪粪各处理组样本中细菌群落的差异性,根据各样本物种丰富度Beta多样性距离矩阵,计算样本间距离的方法为Bray-Curtis,样本间距离越大,说明样本间的细菌群落差异越大。基于距离矩阵进行PCoA分析(见图6b),原猪粪与厌氧消化后各处理组的微生物群落分布完全分离,表明经过厌氧消化,微生物群落发生了重大变化。此外,在厌氧消化的不同阶段,微生物群落的分布也存在明显差异,与R0反应器相比,在R0 h反应器中,三个阶段的微生物群落在PC2轴方向上存在显著差异。第1天和第15天,两组反应器中的微生物群落分布相似,而第60天系统稳定时,两组反应器的微生物群落分布差异明显,可见,水热预处理对微生物群落分布产生重要影响。
此外,我们利用属水平上的相对丰度柱形图探究两个反应器之间微生物群落的差异性。图7a中展示了各样本中在属水平的细菌组成,Others为相对丰度<5%的物种,各样本间的微生物种类和数量随着处理过程逐步发生变化。
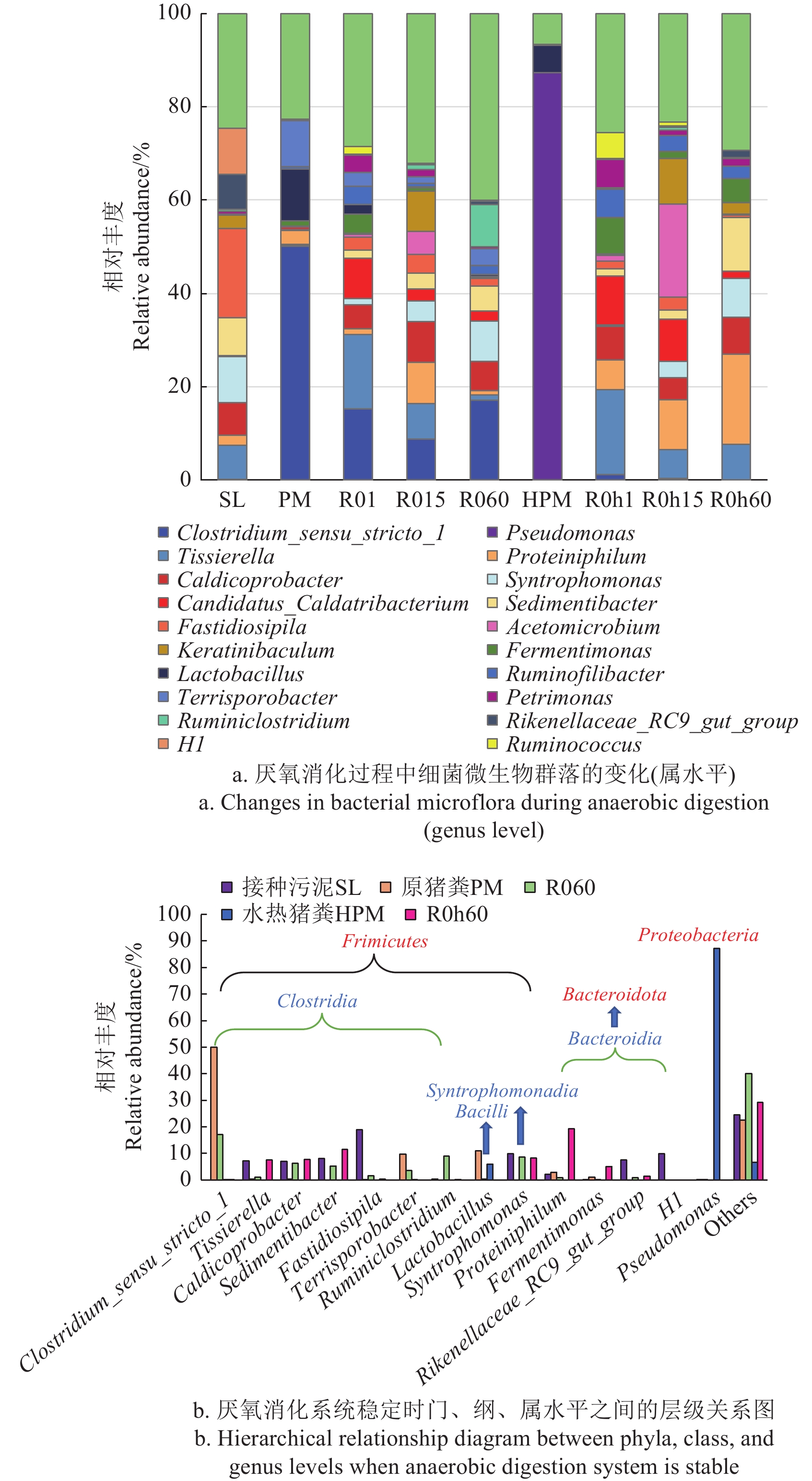
在原猪粪中,优势细菌为Clostridium_sensu_stricto_1(50.08%)、Lactobacillus(11.11%)和Terrisporobacter(9.83%);水热猪粪中优势细菌为Pseudomonas(87.18%)和Lactobacillus(5.92%);在原猪粪厌氧消化反应器运行初期优势菌群为Clostridium_sensu_stricto_1(15.29%)和Tissierella(15.92%);在系统稳定时,优势菌群变为Clostridium_sensu_stricto_1(17.07%)和Ruminiclostridium(9.01%). Clostridium_sensu_stricto_1属于梭状芽孢杆菌,在水解碳水化合物和蛋白质中起着至关重要的作用[38]。在水热猪粪厌氧消化反应器运行初期优势菌群为Tissierella(18.15%)和 Candidatus_Caldatribacterium(10.52%);在系统稳定时,优势菌群变为Proteiniphilum(19.34%)和Sedimentibacter(11.51%)。SUN等[39]报道 Tissierella是一种发酵酸性细菌,其丰度的增加会促进VFAs的产生。Tissierella在R060与R0 h60样本中的相对丰度分别为1.15% 、7.63%,经过水热预处理后,Tissierella 的相对丰度增加了5.63倍,表明水热预处理会促进VFAs的产生。在厌氧消化第60天时,Proteiniphilum在R0与R0 h反应器中的相对丰度分别为1.02%、19.34%,对比未水热预处理,经过水热预处理后Proteiniphilum相对丰度提高了17.96倍,Proteiniphilum属于拟杆菌门( Bacteroidetes ),被称为氨基酸降解菌[40]和丙酸产生菌[41],其相对丰度的增加表明水热预处理能够促进丙酸和乙酸的生成。ZHANG等[42]发现,在厌氧消化过程中,Proteiniphilum的存在对于优化挥发性脂肪酸的组成和加速甲烷产生具有作用,因此,经过水热预处理后,产乙酸嗜蛋白菌(Proteiniphilum)相对丰度的提高,猪粪水解更彻底,产甲烷性能更高。
图7b反应了反应器稳定时(第60天)门、纲、属水平上的层级关系。从图中可以得知,系统中优势菌门为Firmicutes、 Bacteroidota和Proteobacteria, 其中厚壁菌门(Firmicutes)主要包括Tissierella、Clostridium_sensu_stricto_1、Caldicoprobacter、Sedimentibacter、Fastidiosipila等菌属;拟杆菌门(Bacteroidota)主要包括Proteiniphilum、Fermentimonas、Rikenellaceae_RC9_gut_group等菌属;变形菌门(Proteobacteria)包括Pseudomonas菌属。厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidota)所占比例最大。厚壁菌门是厌氧消化产甲烷过程中参与水解和发酵的重要微生物[43]。ZHANG等[44]研究表明,产甲烷菌的Firmicutes在厌氧处理阶段起着关键作用,YAN等[45]研究发现拟杆菌属物种(Bacteroidales)是微生物组中抗生素抗性基因的储存库,且被证明与抗生素的降解相关[46]。厚壁菌门和拟杆菌门组成的微生物簇与抗生素去除呈正相关[47],因此,提高厚壁菌门和拟杆菌门的相对丰度有利于抗生素的去除。在纲水平进一步比较分析两反应器中的微生物群落变化,发现Clostridia、Bacteroidia是两个反应器中的主要微生物。Clostridia 是一大群厌氧或微需氧的粗大芽孢杆菌的总称,对不良环境条件具有极强的抵抗力[23],两组反应器中Clostridia 的相对丰度均较高。
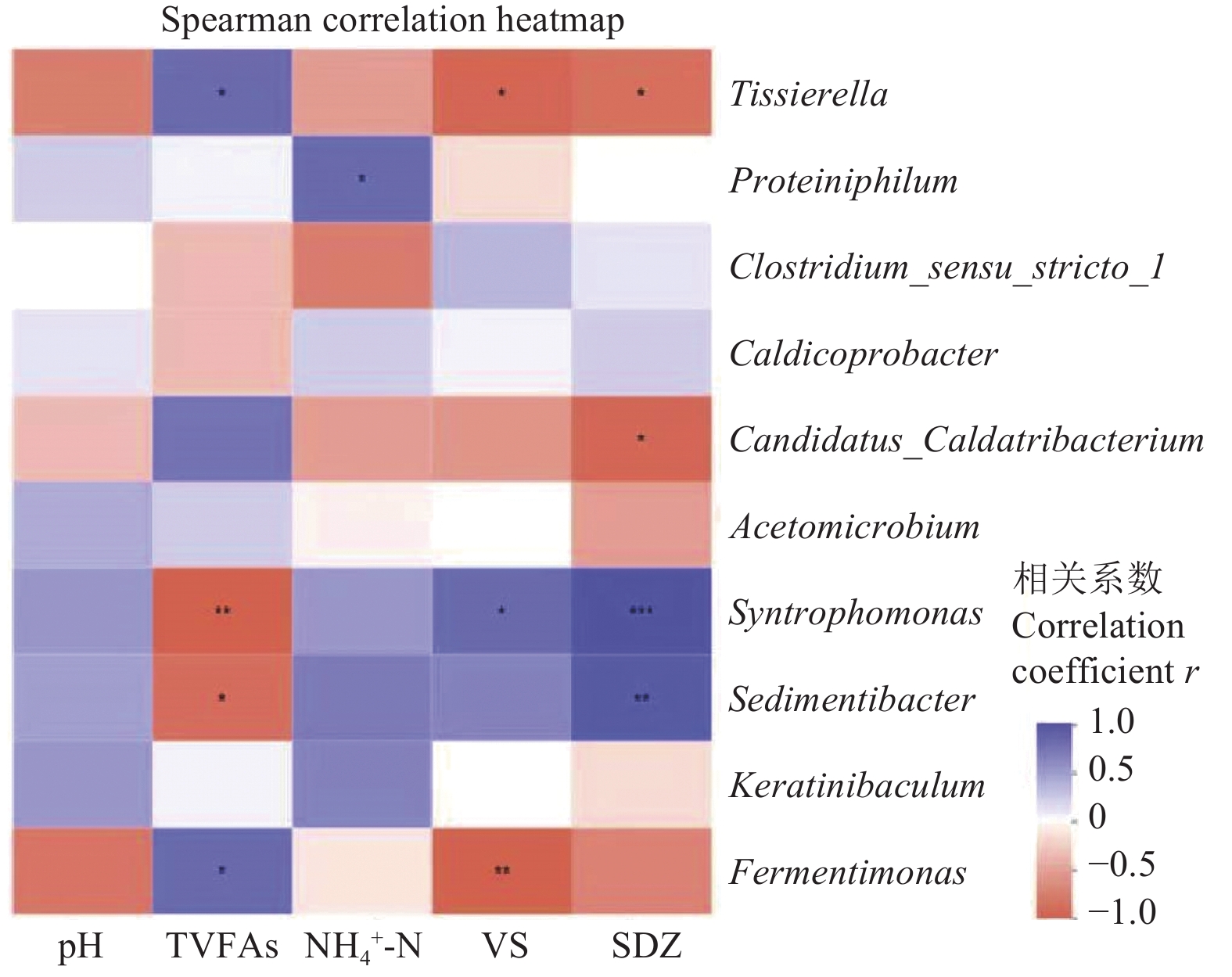
利用相关性Heatmap图用来分析微生物与环境变量之间的相关关系。如图8所示,TVFAs与Tissierella、Fermentimonas呈正相关,与Syntrophomonas、 Sedimentibacter呈负相关(r>0.8,P<0.05)。Tissierella是一种发酵酸性菌[39],其聚集可以提高VFAs的浓度。R060与R0 h60样品中较低的Tissierella相对丰度(图7a),可能意味着其VFAs浓度低于R01与R0 h1样品中。 Proteiniphilum与NH4+-N之间有较强的正相关关系(r>0.8,P<0.05)。这与上文提到的Proteiniphilum是氨基酸降解菌一致,其丰度的增加可能会导致氨氮浓度的上升。SDZ与Syntrophomonas、Sedimentibacter之间存在正相关关系(r>0.9,P<0.01),随着抗生素浓度的增加,其相对丰度逐渐增加,表明抗生素的添加有利于这些细菌的生长。此外,也有一些研究报道Sedimentibacter与抗生素的去除呈正相关[47]。经过水热预处理后Sedimentibacter的相对丰度较未水热预处理显著提升,在厌氧消化第60天,R0反应器中Sedimentibacter的相对丰度为5.29%,R0 h反应器中相对丰度为11.51%,经过水热预处理后其相对丰度提高了117.58%,同时经过水热预处理后抗生素去除率由42.74%提高到60.51%,表明水热预处理可以提高抗生素的降解。
![]() 图 8 厌氧消化过程中微生物群落与环境变量之间的相关关系注:pH代表pH值;TVFAs代表总挥发性脂肪酸;NH4+-N代表氨氮;VS代表挥发性固体;SDZ代表磺胺嘧啶;*,0.01<P≤0.05;**,0.001<P≤0.01;***,P<0.001。Figure 8. Correlation between microbial communities and environmental variables during anaerobic digestionNote: pH represents pH value; TVFAs represents total volatile fatty acids; NH4+-N represents ammonia nitrogen; VS represents volatile solids; SDZ represents sulfadiazine; *, 0.01<P≤0.05; **, 0.001<P≤0.01; ***, P<0.001.
图 8 厌氧消化过程中微生物群落与环境变量之间的相关关系注:pH代表pH值;TVFAs代表总挥发性脂肪酸;NH4+-N代表氨氮;VS代表挥发性固体;SDZ代表磺胺嘧啶;*,0.01<P≤0.05;**,0.001<P≤0.01;***,P<0.001。Figure 8. Correlation between microbial communities and environmental variables during anaerobic digestionNote: pH represents pH value; TVFAs represents total volatile fatty acids; NH4+-N represents ammonia nitrogen; VS represents volatile solids; SDZ represents sulfadiazine; *, 0.01<P≤0.05; **, 0.001<P≤0.01; ***, P<0.001.3. 结 论
1) 水热预处理可促进猪粪中温厌氧消化,提高产气量。经过水热预处理日产沼气量显著提升(P <0.05),较未水热预处理反应器提高约34.05%,且容积产气率提高了34.00%,但二者甲烷体积分数差异较小。水热预处理对厌氧消化反应器的稳定性影响不大,其pH值可以保持在7.5左右,TVFAs含量保持在1.0 g/L,VS去除率维持在48%,略高于未经水热预处理的反应器。
2) 水热预处理厌氧消化反应器SDZ的去除率为54.4%~75.2%,显著高于未经水热预处理的单相反应器的40.5%~58.5%(P <0.05)。并且水热预处理可以增强SDZ的降解途径和降解产物,从不同降解路径对SDZ进行生物降解,提高SDZ的去除率。
3) 厚壁菌门和拟杆菌门是厌氧发酵系统中的优势菌,提高其相对丰度有利于抗生素的降解。SDZ浓度与Syntrophomonas、Sedimentibacter之间存在明显的正相关关系。经过水热预处理后Sedimentibacter的相对丰度较未水热预处理显著提升,表明水热预处理可以提高抗生素的降解。
-
图 6 厌氧消化过程中微生物群落的Veen和PCoA图分析
注:SL代表接种污泥;PM代表原猪粪;HPM代表水热猪粪;R01、R015、R060分别代表原猪粪厌氧消化第1、15、60天; R0 h1、R0 h15、R0 h60分别代表水热猪粪厌氧消化第1、15、60天。
Figure 6. Veen and PCoA diagram of microbial communities during anaerobic digestion
Note: SL represents the inoculate sludge; PM represents the raw pig manure; HPM represents the pig manure with HTP; R01, R015, and R060 represent days 1, 15, and 60 of anaerobic digestion of raw pig manure, respectively; R0 h1, R0 h15, and R0 h60 represent days 1, 15, and 60 of anaerobic digestion of pig manure with HTP, respectively.
图 8 厌氧消化过程中微生物群落与环境变量之间的相关关系
注:pH代表pH值;TVFAs代表总挥发性脂肪酸;NH4+-N代表氨氮;VS代表挥发性固体;SDZ代表磺胺嘧啶;*,0.01<P≤0.05;**,0.001<P≤0.01;***,P<0.001。
Figure 8. Correlation between microbial communities and environmental variables during anaerobic digestion
Note: pH represents pH value; TVFAs represents total volatile fatty acids; NH4+-N represents ammonia nitrogen; VS represents volatile solids; SDZ represents sulfadiazine; *, 0.01<P≤0.05; **, 0.001<P≤0.01; ***, P<0.001.
表 1 Alpha多样性指数表
Table 1 Alpha diversity indices of the analyzed samples
样本
SampelsSobs Chao Shannon Shannoneven Coverage SL 230 267.56 4.02 0.74 0.98 PM 111 117.38 2.88 0.61 0.99 R01 133 133.00 3.91 0.80 1.00 R015 247 273.54 4.51 0.82 0.99 R060 241 294.04 4.41 0.80 0.98 HPM 28 28.00 0.76 0.23 1.00 R0 h1 164 165.62 3.92 0.77 1.00 R0 h15 262 343.07 4.11 0.74 0.97 R0 h60 249 275.13 4.26 0.77 0.98 注:Sobs和Chao指数反映了微生物群落丰富度;Shannon指数反映了微生物群落多样性; Shannoneven指数反映了微生物群落的均匀度;Coverage指数反映了微生物群落的覆盖度。
Note: Sobs and Chao indices reflect microbial community richness; Shannon index reflects microbial community diversity; Shannoneven index reflects microbial community evenness; Coverage index reflects microbial community coverage. -
[1] 丁思佳. 水中磺胺嘧啶去除技术研究[D]. 上海:华东理工大学,2019. DING Sijia. Research on the Treatment of Sulfadiazine in Wastewater[D]. Shanghai: East China University of Science and Technology, 2019. (in Chinese with English abstract)
[2] TANG R, YUAN S, CHEN F, et al. Effects of roxarsone and sulfadiazine on biogas production and their degradation during anaerobic digestion[J]. International Biodeterioration & Biodegradation, 2019, 140: 113-118.
[3] ZHENG H, ZHANG Y, LI S, et al. Antibiotic sulfadiazine degradation by persulfate oxidation: Intermediates dependence of ecotoxicity and the induction of antibiotic resistance genes[J]. Bioresource Technology, 2023, 368: 128306. DOI: 10.1016/j.biortech.2022.128306
[4] WOHDE M, BERKNER S, JUNKER T, et al. Occurrence and transformation of veterinary pharmaceuticals and biocides in manure: a literature review[J]. Environmental Sciences Europe, 2016, 28(1): 23. DOI: 10.1186/s12302-016-0091-8
[5] BOXALL A B, FOGG L A, KAY P, et al. Prioritisation of veterinary medicines in the UK environment[J]. Toxicology Letters, 2003, 142(3): 207-218. DOI: 10.1016/S0378-4274(03)00067-5
[6] 强虹,杨祎楠,李娜,等. 金霉素浓度对鸡粪中温厌氧消化特性及抗生素降解的影响[J]. 农业工程学报,2019,35(10):181-190. DOI: 10.11975/j.issn.1002-6819.2019.10.023 QIANG Hong, YANG Yinan, LI Na, et al. Effect of chlortetracycline concentration on mesophilic anaerobic digestion characteristics and antibiotic degradation of chicken manure[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(10): 181-190. (in Chinese with English abstract) DOI: 10.11975/j.issn.1002-6819.2019.10.023
[7] 靳红梅,许彩云,黄红英,等. 猪粪中温厌氧消化中磺胺类抗生素的降解和吸附特征[J]. 农业环境科学学报,2017,36(9):1884-1892. JIN Hong-mei, XU Cai-yun, HUANG Hongying, et al. The degradation and adsorption of sulfonamides in mesophilic anaerobic digestion of swine manure[J]. Journal of Agro-Environment Science, 2017, 36(9): 1884-1892. (in Chinese with English abstract)
[8] ZHENG J, WANG S, ZHOU A, et al. Efficient elimination of sulfadiazine in an anaerobic denitrifying circumstance: Biodegradation characteristics, biotoxicity removal and microbial community analysis[J]. Chemosphere, 2020, 252: 126472. DOI: 10.1016/j.chemosphere.2020.126472
[9] YIN F, DONG H, ZHANG W, et al. Additional function of pasteurisation pretreatment in combination with anaerobic digestion on antibiotic removal[J]. Bioresource Technology, 2019, 297: 122414.
[10] AWAD M, TIAN Z, ZHANG Y, et al. Hydrothermal pretreatment of oxytetracycline fermentation residue: Removal of oxytetracycline and increasing the potential for anaerobic digestion[J]. Environmental Engineering Research, 2020.
[11] LI C. Hydrothermal pretreatment for biogas production from anaerobic digestion of antibiotic mycelial residue[J]. Chemical Engineering Journal, 2015, 279: 530-537. DOI: 10.1016/j.cej.2015.05.073
[12] KIM S, LEE C, KIM J, et al. Feasibility of thermal hydrolysis pretreatment to reduce hydraulic retention time of anaerobic digestion of cattle manure[J]. Bioresource Technology, 2023, 384: 129308.
[13] PEI J, YAO H, WANG H, et al. Comparison of ozone and thermal hydrolysis combined with anaerobic digestion for municipal and pharmaceutical waste sludge with tetracycline resistance genes[J]. Water Research, 2016, 99 122-128.
[14] WANG L, YOU L, ZHANG J, et al. Biodegradation of sulfadiazine in microbial fuel cells: Reaction mechanism, biotoxicity removal and the correlation with reactor microbes[J]. Journal of Hazardous Materials, 2018, 360: 402-411.
[15] DENG Y, MAO Y, LI B, et al. Aerobic Degradation of Sulfadiazine by Arthrobacter spp.: Kinetics, Pathways and Genomic Characterization[J]. Environmental Science & Technology, 2016, 50(17): 9566.
[16] 董仁杰,张紫嘉,刘晟,等. 水热预处理对猪粪厌氧消化及沼液生态安全性的影响[J]. 农业工程学报,2022,38(6):193-203. DOI: 10.11975/j.issn.1002-6819.2022.06.022 DONG Renjie, ZHANG Zijia, LIU Sheng, et al. Effects of hydrothermal pretreatments on the anaerobic digestion of pig manure and ecological safety of biogas slurry[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2022, 38(6): 193-203. (in Chinese with English abstract) DOI: 10.11975/j.issn.1002-6819.2022.06.022
[17] XING N, QIN J, REN D, et al. Integrating UPLC-Q-Exactive Orbitrap/MS, network pharmacology and experimental validation to reveal the potential mechanism of Tibetan medicine Rhodiola granules in improving myocardial ischemia-reperfusion injury[J]. Journal of Ethnopharmacology, 2023, 314: 116572. DOI: 10.1016/j.jep.2023.116572
[18] TAN C, LUO Y, FU T. Soil microbial community responses to the application of a combined amendment in a historical zinc smelting area[J]. Environmental Science and Pollution Research, 2022, 29(4396): 1-15.
[19] SCHLOSS P D, WESTCOTT S L, RYABIN T, et al. Introducing mothur: Open-source, platform-independent, community-supported software for describing and comparing microbial communities[J]. Applied & Environmental Microbiology, 2009, 75: 7537.
[20] DE OLIVEIRA PARANHOS A G, PEREIRA A R, NUNES COELHO L D, et al. Hydrothermal pre-treatment followed by anaerobic digestion for the removal of tylosin and antibiotic resistance agents from poultry litter[J/OL]. Environmental Science and Pollution Research International, 2023, 30: 42443-42455. https://doi.org/10.1007/s11356-023-25329-6.
[21] MITCHELL S M, ULLMAN J L, TEEL A L, et al. Hydrolysis of amphenicol and macrolide antibiotics: Chloramphenicol, florfenicol, spiramycin, and tylosin[J]. Chemosphere, 2015, 134: 504-511 DOI: 10.1016/j.chemosphere.2014.08.050
[22] SEVCAN, AYDIN, BAHAR, et al. Combined effect of erythromycin, tetracycline and sulfamethoxazole on performance of anaerobic sequencing batch reactors[J]. Bioresource Technology, 2015, 186: 207-214. DOI: 10.1016/j.biortech.2015.03.043
[23] 孔令姣. 抗生素混合物对厌氧处理微生物群落和抗性基因影响机制[D]. 合肥:安徽大学,2022. KONG Lingjiao. The Effect Mechanism of Antibiotic Mixtures on Microbial Community and Antibiotic Resistance Genes in Anaerobic Biological Treatment System[D]. Hefei: Anhui University, 2022. (in Chinese with English abstract)
[24] 张紫嘉. 水热预处理对猪粪厌氧消化及其典型抗生素消减的影响[D]. 北京:中国农业大学,2022. ZHANG Zijia. Effects of Hydrothermal Pretreatment on Anaerobic Digestion of Pig Manure and Reduction of Typical Antibiotics[J]. Beijing: China Argricultural University, 2022. (in Chinese with English abstract)
[25] MUELLER E, SCHUESSLER W, HORN H, et al. Aerobic biodegradation of the sulfonamide antibiotic sulfamethoxazole by activated sludge applied as co-substrate and sole carbon and nitrogen source[J]. Chemosphere, 2013, 92(8): 969-978.
[26] ZHANG Y, HU S, ZHANG H, et al. Degradation kinetics and mechanism of sulfadiazine and sulfamethoxazole in an agricultural soil system with manure application[J]. Science of The Total Environment, 2017, 607/608: 1348-1356. DOI: 10.1016/j.scitotenv.2017.07.083
[27] TANG T, LIU M, CHEN Y, et al. Influence of sulfamethoxazole on anaerobic digestion: Methanogenesis, degradation mechanism and toxicity evolution[J]. Journal of Hazardous Materials, 2022, 431: 128540. DOI: 10.1016/j.jhazmat.2022.128540
[28] ZHAO Q, GUO W, LUO H, et al. Insights into removal of sulfonamides in anaerobic activated sludge system: Mechanisms, degradation pathways and stress responses[J]. Journal of Hazardous Materials, 2022, 423: 127248. DOI: 10.1016/j.jhazmat.2018.08.021
[29] ZOU X, ZHOU T, MAO J, et al. Synergistic degradation of antibiotic sulfadiazine in a heterogeneous ultrasound-enhanced Fe0/persulfate Fenton-like system[J]. Chemical Engineering Journal, 2014, 257: 36-44. DOI: 10.1016/j.cej.2014.07.048
[30] 王明,赵胜雪,李旭荣,等. 猪粪中温半干法连续厌氧发酵产气性能[J]. 农业工程学报,2018,34(1):204-209. DOI: 10.11975/j.issn.1002-6819.2018.01.28 WANG Ming, ZHAO Shengxue, LI Xurong, et al. Biogas production performance of swine manure by mesophilic semi-dry continuous anaerobic digestion[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(1): 204-209. (in Chinese with English abstract) DOI: 10.11975/j.issn.1002-6819.2018.01.28
[31] CERóN Á A C, VIDAL A P, LOZADA P T J S E T. Importancia del pH y la alcalinidad en el tratamiento anaerobio de las aguas residuales del proceso de extracción de almidón de yuca[J]. Scientia et Technica, 2005, 11(27): 243-248.
[32] WANG L, ZHOU Q, LI F. Avoiding propionic acid accumulation in the anaerobic process for biohydrogen production[J]. Biomass and bioenergy, 2006, 30(2): 177-182. DOI: 10.1016/j.biombioe.2005.11.010
[33] ZHAO M, YAN Q, RUAN W, et al. Effects of butyric acid stress on anaerobic sludge for hydrogen production from kitchen wastes[J]. Journal of Chemical Technology & Biotechnology, 2010, 85(6): 866-871.
[34] 乔玮,毕少杰,熊林鹏,等. 氨氮浓度对鸡粪中高温甲烷发酵的影响[J]. 中国环境科学,2019,39(7):2921-2927. DOI: 10.3969/j.issn.1000-6923.2019.07.028 QIAO Wei, BI Shaojie, XIONG Linpeng, et al. Effects of ammonium on methane fermentation of chicken manure under mesophilic and thermophilic conditions[J]. China Environmental Science, 2019, 39(7): 2921-2927. (in Chinese with English abstract) DOI: 10.3969/j.issn.1000-6923.2019.07.028
[35] 韩捷,向欣,程红胜,等. 好氧预处理对干法沼气发酵产气量的影响及能量损失[J]. 农业工程学报,2011,27(12):246-249. HAN Jie, XIANG Xin, CHENG Hongsheng, et al. Effects of aerobic fermentation pre-treatment on dry anaerobic fermentation gas production and its energy loss[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2011, 27(12): 246-249. (in Chinese with English abstract)
[36] 范润. 高温与超高温水解强化猪粪厌氧发酵性能研究[D]. 北京:中国农业大学,2021. FAN Run. Enhanced Anerobic Digestion Performance of Pig Manure by Thermophilic and Hyperthermophilic Hydrolysis[D]. Beijing: China Agricultural University, 2021. (in Chinese with English abstract)
[37] 赵可歆,尹振东,张可可,等. 复合垂直流人工湿地植物与基质层微生物群落特征比较分析[J]. 中国水产科学,2022,29(6):874-889. ZHAO Kexin, YIN Zhendong, ZHANG Keke, et al. Comparision of microbial community characteristics in plant rhizosphere and other substrates in an integrated vertical flow constructed wetland[J]. Journal of Fishery Sciences of China, 2022, 29(6): 874-889. (in Chinese with English abstract)
[38] XIONG Z Y, HUSSAIN ABID, LEE JANGHO, et al. Food waste fermentation in a leach bed reactor: Reactor performance, and microbial ecology and dynamics[J]. Bioresource Technology, 2018, 274: 153-161.
[39] SUN W M, SUM X X, CUPPLES ALISON M . Identification of desulfosporosinus as toluene-assimilating microorganisms from a methanogenic consortium[J]. International Biodeterioration & Biodegradation, 2014, 88: 13-19.
[40] ZEPPILLI M, VILLANO M, AULENTA F, et al. Effect of the anode feeding composition on the performance of a continuous-flow methane-producing microbial electrolysis cell[J]. Environmental Science and Pollution Research, 2015, 22(10): 7349-7360. DOI: 10.1007/s11356-014-3158-3
[41] XIONG Y, HARB M, HONG P-Y. Performance and microbial community variations of anaerobic digesters under increasing tetracycline concentrations[J]. Applied Microbiology and Biotechnology, 2017, 101(13): 5505-5517. DOI: 10.1007/s00253-017-8253-1
[42] ZHANG J, LOH K-C, LEE J, et al. Three-stage anaerobic co-digestion of food waste and horse manure[J]. Scientific reports, 2017, 7(1): 1-10. DOI: 10.1038/s41598-016-0028-x
[43] AWAD M, TIAN Z, ZHANG Y, et al. Hydrothermal pretreatment of oxytetracycline fermentation residue: Removal of oxytetracycline and increasing the potential for anaerobic digestion[J]. Environmental Engineering Research, 2021, 26(4): 200258.
[44] ZHANG J, MAO F, LOH K-C, et al. Evaluating the effects of activated carbon on methane generation and the fate of antibiotic resistant genes and class I integrons during anaerobic digestion of solid organic wastes[J]. Bioresource Technology, 2018, 249: 729-736. DOI: 10.1016/j.biortech.2017.10.082
[45] YAN W, HALL A B, JIANG X. Bacteroidales species in the human gut are a reservoir of antibiotic resistance genes regulated by invertible promoters[J]. NPJ Biofilms Microbiomes, 2022, 8(1): 1. DOI: 10.1038/s41522-021-00260-1
[46] 江承亮,李鸿毅,王行,等. 蝇蛆肠道微生物菌群对猪粪残留抗生素的降解及抗性基因的影响[J]. 微生物学报,2018,58(6):1103-1115. DOI: 10.13343/j.cnki.wsxb.20170318 JIANG Chengliang, LI Hongyi, WANG Hang, et al. Housefly larvae gut microbiome may attenuate veterinary antibiotics and alter the resistome in swine manure[J]. Acta Microbiologica Sinica, 2018, 58(6): 1103-1115. (in Chinese with English abstract) DOI: 10.13343/j.cnki.wsxb.20170318
[47] ZHANG J, YUE Z, ZHOU Z, et al. Key microbial clusters and environmental factors affecting the removal of antibiotics in an engineered anaerobic digestion system[J]. Bioresource Technology, 2022, 348: 126770. DOI: 10.1016/j.biortech.2022.126770
-
期刊类型引用(5)
1. 朱燕云,靳红梅,龙玉娇,朱宁,王欣,冯彦房,曹云,张晶. 水热炭基纳米硒对猪粪中温和中高温产甲烷及砷去除的影响. 农业工程学报. 2025(01): 258-267 .  本站查看
本站查看
2. 任建军,毛洪刚,朱李霞,夏禧龙,周蓉蓉,韩丽丽,马娜,尹冬敏. 红霉素菌渣厌氧消化产气潜能及动力学特性. 农业工程学报. 2024(09): 199-208 .  本站查看
本站查看
3. 金翝启,姜荣杰,王子睿,李璐杨,罗景阳. 典型抗生素对污泥厌氧消化效能的影响及调控策略研究进展. 环境工程. 2024(07): 49-59 .  百度学术
百度学术
4. 关奂奂. 高级氧化技术降解磺胺类抗生素的应用研究. 工业用水与废水. 2024(05): 7-12+37 .  百度学术
百度学术
5. 张怡人,任雷,刘洋. 水环境中磺胺类抗生素的自然衰减过程及相关监测方法. 山东化工. 2024(21): 222-224+227 .  百度学术
百度学术
其他类型引用(3)




 下载:
下载:
 下载:
下载:












